Forfatter:
Bobbie Johnson
Oprettelsesdato:
10 April 2021
Opdateringsdato:
1 Juli 2024
Indhold
- Trin
- Del 1 af 2: Forbered udstyret
- Del 2 af 2: Udfør et eksperiment
- Tips
- Advarsler
- Hvad har du brug for
Vandspaltningsproces (H2O) i dets bestanddele (hydrogen og ilt) ved hjælp af elektricitet kaldes elektrolyse. Gasserne opnået som følge af elektrolyse kan bruges alene - for eksempel fungerer hydrogen som en af de reneste energikilder. Selvom navnet på denne proces kan lyde lidt smart, er det faktisk lettere end det ser ud til, hvis du har det rigtige udstyr, viden og lidt erfaring.
Trin
Del 1 af 2: Forbered udstyret
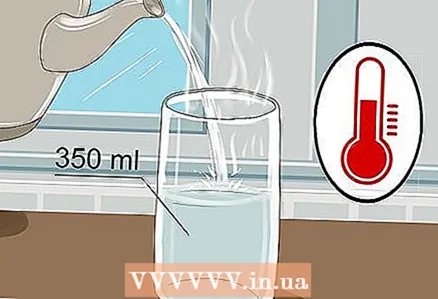 1 Tag et 350 ml glas og hæld varmt vand i det. Det er ikke nødvendigt at fylde glasset til randen, bare lidt vand er nok. Koldt vand vil klare sig, selvom varmt vand leder elektricitet bedre.
1 Tag et 350 ml glas og hæld varmt vand i det. Det er ikke nødvendigt at fylde glasset til randen, bare lidt vand er nok. Koldt vand vil klare sig, selvom varmt vand leder elektricitet bedre. - Både postevand og flaskevand vil klare sig.
- Varmt vand har en lavere viskositet, hvilket gør det lettere for ioner at bevæge sig rundt.
 2 Opløs 1 spsk (20 gram) bordsalt i vand. Hæld salt i et glas og rør vandet for at opløses. Dette vil skabe en saltopløsning.
2 Opløs 1 spsk (20 gram) bordsalt i vand. Hæld salt i et glas og rør vandet for at opløses. Dette vil skabe en saltopløsning. - Natriumchlorid (dvs. bordsalt) er en elektrolyt, der øger vandets elektriske ledningsevne. I sig selv leder vand ikke elektricitet godt.
- Når du øger vandets elektriske ledningsevne, vil strømmen skabt af batteriet lettere passere gennem opløsningen og mere effektivt nedbryde molekylerne til brint og ilt.
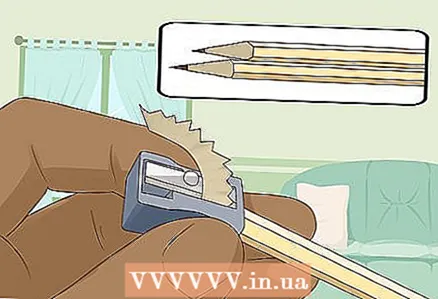 3 Slib to hårde bløde blyanter i begge ender for at afsløre føringen. Glem ikke at fjerne viskelæderet fra dine blyanter. En grafitstang skal stikke ud i begge ender.
3 Slib to hårde bløde blyanter i begge ender for at afsløre føringen. Glem ikke at fjerne viskelæderet fra dine blyanter. En grafitstang skal stikke ud i begge ender. - Grafitstængerne fungerer som isolerede elektroder, som du tilslutter batteriet til.
- Grafit er velegnet til dette forsøg, fordi det ikke opløses eller korroderer i vand.
 4 Skær et stykke pap ud, der er stort nok til at ligge oven på glasset. Brug et temmelig tykt stykke karton, der ikke hænger, når du har stanset to huller i det. Skær et firkantet stykke ud af en skokasse eller lignende.
4 Skær et stykke pap ud, der er stort nok til at ligge oven på glasset. Brug et temmelig tykt stykke karton, der ikke hænger, når du har stanset to huller i det. Skær et firkantet stykke ud af en skokasse eller lignende. - Papen bruges til at holde blyanterne i vandet, så de ikke rører siderne og bunden af glasset.
- Pap er ikke ledende, så du kan roligt lægge det på et glas.
 5 Brug blyanter til at stikke to huller i pap. Stik huller i kartonen med blyanter - i dette tilfælde bliver de spændt fast og glider ikke. Sørg for, at grafitten ikke rører siderne eller bunden af glasset, ellers vil det forstyrre eksperimentet.
5 Brug blyanter til at stikke to huller i pap. Stik huller i kartonen med blyanter - i dette tilfælde bliver de spændt fast og glider ikke. Sørg for, at grafitten ikke rører siderne eller bunden af glasset, ellers vil det forstyrre eksperimentet.
Del 2 af 2: Udfør et eksperiment
 1 Tilslut en ledning med alligatorclips til hver batteripol. Batteriet fungerer som en kilde til elektrisk strøm, og gennem ledningerne med klemmer og grafitstænger når strømmen vandet.Tilslut den ene ledning med en klemme til den positive og den anden til den negative terminal på batteriet.
1 Tilslut en ledning med alligatorclips til hver batteripol. Batteriet fungerer som en kilde til elektrisk strøm, og gennem ledningerne med klemmer og grafitstænger når strømmen vandet.Tilslut den ene ledning med en klemme til den positive og den anden til den negative terminal på batteriet. - Brug et 6 volt batteri. Hvis du ikke har et, kan du i stedet bruge et 9-volts batteri.
- Et passende batteri kan fås fra en elforsyningsbutik eller et supermarked.
 2 Tilslut de andre ender af ledningerne til blyanterne. Fastgør metaltrådklemmerne fast til grafitstængerne. Du skal muligvis skrælle noget mere træ af blyanterne for at forhindre, at clipsene glider af grafitstængerne.
2 Tilslut de andre ender af ledningerne til blyanterne. Fastgør metaltrådklemmerne fast til grafitstængerne. Du skal muligvis skrælle noget mere træ af blyanterne for at forhindre, at clipsene glider af grafitstængerne. - Således lukker du kredsløbet, og strøm fra batteriet strømmer gennem vandet.
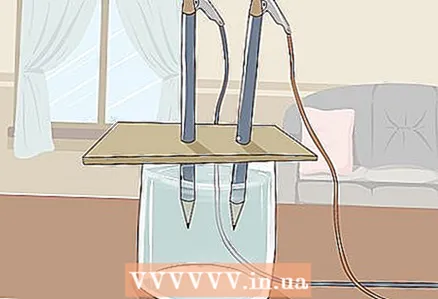 3 Læg pap på glasset, så blyanternes frie ender er nedsænket i vandet. Kartonarket skal være stort nok til at hvile på glasset. Pas på ikke at forstyrre den korrekte placering af blyanterne.
3 Læg pap på glasset, så blyanternes frie ender er nedsænket i vandet. Kartonarket skal være stort nok til at hvile på glasset. Pas på ikke at forstyrre den korrekte placering af blyanterne. - For at forsøget kan lykkes, må grafitten ikke røre glasets vægge og bund. Kontroller dette igen, og juster blyanterne om nødvendigt.
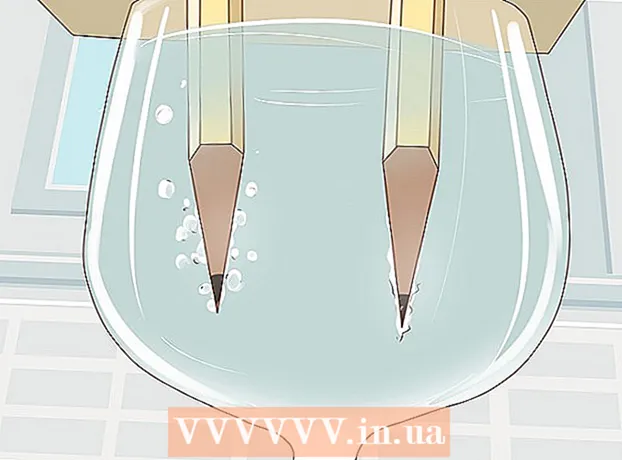
 4 Se vandet splitte i brint og ilt. Gasbobler begynder at stige fra grafitstængerne nedsænket i vandet. Disse er brint og ilt. Hydrogen frigives ved den negative pol og ilt ved den positive pol.
4 Se vandet splitte i brint og ilt. Gasbobler begynder at stige fra grafitstængerne nedsænket i vandet. Disse er brint og ilt. Hydrogen frigives ved den negative pol og ilt ved den positive pol. - Så snart du slutter ledningerne til batteriet og grafitstængerne, strømmer en elektrisk strøm gennem vandet.
- Flere gasbobler dannes på blyanten, der er forbundet til den negative pol, da hvert vandmolekyle består af to hydrogenatomer og et oxygenatom.
Tips
- Hvis du ikke har blyanter med grafitskaft, kan du i stedet bruge to små ledninger. Bare vikl den ene ende af hver ledning omkring den tilsvarende batteristang og dypp den anden i vandet. Resultatet bliver det samme som med blyanter.
- Prøv at bruge et andet batteri. Mængden af strøm, der strømmer, afhænger af batteriets spænding, hvilket igen påvirker splittelsen af vandmolekyler.
Advarsler
- Hvis du tilføjer en elektrolyt, såsom salt, til vandet, skal du huske på, at eksperimentet vil generere en lille mængde af et biprodukt, såsom chlor. Det er sikkert i så små mængder, men du kan lugte en let klor lugt.
- Udfør dette eksperiment under voksen opsyn. Det er forbundet med elektricitet og gasser og kan derfor være farligt, men usandsynligt.
Hvad har du brug for
- To hårdtbløde blyanter
- Et 6 eller 9 volt batteri
- Glas med et volumen på 350 milliliter
- 2 tråde med krokodilleklip
- Slibemaskine til blyant
- Salt