Forfatter:
Randy Alexander
Oprettelsesdato:
25 April 2021
Opdateringsdato:
26 Juni 2024
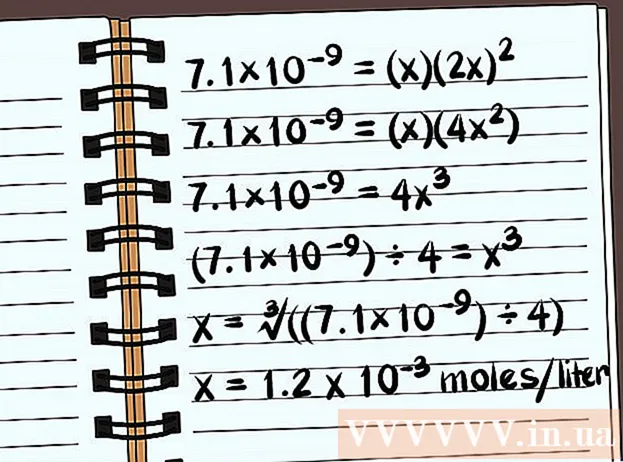
Indhold
I kemi anvendes opløselighed til at beskrive egenskaberne af en fast forbindelse, når den er fuldstændigt opløst i en væske uden at efterlade nogen uopløselig rest. Kun ioniske forbindelser (ladede) er opløselige. Faktisk behøver du kun huske nogle få regler eller slå op i litteraturen for at vide, om en ionisk forbindelse forbliver fast, når den tilsættes til vand, eller hvis en stor mængde opløses. Faktisk vil en vis mængde molekyler opløses, selvom du ikke ser nogen ændring, så for at eksperimentet skal være nøjagtigt, skal du vide, hvordan du beregner denne mængde opløst stof.
Trin
Metode 1 af 2: Brug hurtige regler
Lær om ioniske forbindelser. Hvert atom har normalt et bestemt antal elektroner, men nogle gange får eller giver det en elektron. Denne proces gør det til en ioner opkrævet. Når en ion med en negativ ladning (overskud af en elektron) støder på en ion med en positiv ladning (mangler en elektron), binder de sig sammen som katoden og anoden på to magneter. Resultatet danner en ionisk forbindelse.
- Ioner har en negativ ladning kaldet anioner, og ioner kaldes en positiv ladning kation.
- Normalt er antallet af elektroner i et atom lig med antallet af protoner, så det har ingen opladning.

Forstå opløselighed. Vandmolekyle (H2O) har en usædvanlig struktur, så den ligner en magnet: den ene ende har en positiv ladning og den anden har en negativ ladning. Når du lægger en ionforbindelse i vand, samles disse vandmagneter omkring det og prøver at trække de positive og negative ioner fra hinanden.- Nogle ioniske forbindelser absorberes ikke meget tæt, de overvejes opløselig Fordi det adskilles og opløses, når det tilsættes til vand. Andre forbindelser har stærkere bindinger uopløselig fordi ionerne er tæt tiltrukket af hinanden uanset vandmolekylets tiltrækningskraft.
- Nogle forbindelser har en bindingskraft svarende til tiltrækningen af et vandmolekyle. De overvejes let opløselig fordi de fleste forbindelser vil blive adskilt, men resten vil stadig blive tiltrukket af hinanden.

Forstå opløsningsprincippet. Fordi interaktionerne mellem atomer er så komplekse, kan du ikke helt stole på intuition for at skelne mellem hvilke forbindelser der kan eller ikke kan. Slå den første ion op i forbindelsen på listen nedenfor for dens fælles egenskaber, og kontroller derefter for undtagelser for at sikre, at den anden ion ikke interagerer unormalt med den.- For eksempel for at kontrollere strontiumchlorid (SrCl2), se efter Sr eller Cl i fed skrift nedenfor. Cl er "normalt opløselig", så tjek for undtagelser under det. Sr er ikke på undtagelseslisten, så SrCl2 skal være opløselig.
- De mest almindelige undtagelser fra hver regel er skrevet under reglen. Der er andre undtagelser, men disse vil sandsynligvis ikke forekomme i normal kemi eller laboratorietid.

Forbindelser er opløselige, når de indeholder alkalimetaller, såsom Li, Na, K, Rb og Cs. Disse metaller er også kendt som gruppe IA-elementer: lithium, natrium, kalium, rubidium og cæsium. Næsten alle forbindelser, der indeholder en af disse ioner, er opløselige.- Undtagelse: Li3PO4 uopløselig.
INGEN forbindelser3, C2H3O2, NEJ2ClO3 og ClO4 er alle opløselige. Navnene svarende til de ovennævnte ioner er nitrat, acetat, nitrit, chlorat og perchlorat. Bemærk, at acetat ofte forkortes som OAc.
- Undtagelse: Ag (OAc) (sølvacetat) og Hg (OAc)2 (kviksølvacetat) uopløselig.
- AgNO2 og KClO4 kun "let smeltet".
Forbindelserne af Cl, Br og I er sædvanligvis opløselige. Klorid-, bromid- og iodidioner danner næsten altid opløselige forbindelser, kaldet halogensalte.
- Undtagelse: Hvis nogen af de ovennævnte ioner kombineres med sølvioner Ag, kviksølv Hg2eller Pb-bly, vil danne uopløselige forbindelser. Det samme gælder for de mindre almindelige forbindelser, der dannes, når de kombineres med kobber Cu og thali Tl.
Forbindelser indeholdende SO4 normalt opløselig. Sulfationer danner ofte opløselige forbindelser, men der er mange undtagelser.
- Undtagelse: Sulfationer danner uopløselige forbindelser med følgende ioner: strontium Sr, barium Ba, bly Pb, sølv Ag, calcium Ca, radium Ra og sølvatomer af Ag2. Bemærk, at sølvsulfat og calciumsulfat kun er moderat opløselige, så nogle anser dem for at være let opløselige.
Stoffer, der indeholder OH eller S, er uopløselige. De tilsvarende navne på disse ioner er hydroxider og sulfider.
- Undtagelse: Kan du huske alkalimetaller (gruppe I-A), og hvordan de kan danne opløselige forbindelser? Li, Na, K, Rb og Cs danner alle forbindelser, der er opløselige med hydroxid- eller sulfidioner. Derudover danner hydroxider salte, der er opløselige med jordalkalimetalioner (gruppe II-A): calcium Ca, strontium Sr og barium Ba. Bemærk: forbindelser fremstillet af hydroxider og jordalkalimetaller har faktisk et betydeligt antal molekyler, der forbliver bundet sammen, så de betragtes undertiden som "let opløselige".
CO-holdige forbindelser3 eller PO4 uopløselig. Kontroller en sidste gang for carbonat- og fosfationerne, og du vil se, om din forbindelse er opløselig.
- Undtagelse: Disse ioner danner forbindelser, der er opløselige med alkalimetaller, såsom Li, Na, K, Rb og Cs, såvel som med ammoniumionen NH4.
Metode 2 af 2: Beregn opløseligheden ud fra konstanten Ksp
Slå op på opløselighedsproduktets konstante Ksp. Denne konstant er forskellig for hver forbindelse, så du skal slå den op på en graf i en lærebog eller online. Da disse værdier bestemmes eksperimentelt og kan variere betydeligt mellem grafer, er det bedst at bruge lærebogsgrafen, hvis den er tilgængelig. Medmindre andet er angivet, antager de fleste plots en testtemperatur på 25 ° C.
- Lad os for eksempel sige, at du opløser blyjodid med formlen PbI2, skriv dets opløselighedsproduktkonstant. Hvis du henviser til grafen på bilbo.chm.uri.edu, bruger du konstanten 7,1 × 10.
Skriv en kemisk ligning. Den første bestemmer det ioniske separationsmønster for denne forbindelse, når den er opløst. Skriv derefter ligningen med Ksp på den ene side og komponentioner på den anden side.
- For eksempel et PbI-molekyle2 adskilles i ioner Pb, I og I. (Du behøver kun at kende eller kontrollere ladningen af en ion, da alle forbindelser altid er elektrisk neutrale).
- Skriv ligningen 7,1 × 10 =
- Denne ligning er opløselighedskonstanten, du kan finde ud af for 2 ioner i opløselighedstabellen. Da der er 2 l-ioner, skal l- være kvadratisk.
Transformer ligninger for at bruge variabler. Omskriv ligningen ved hjælp af normale algebraiske metoder ved hjælp af de oplysninger, du kender til antallet af molekyler og ioner. Indstil x lig med massen af forbindelsen, der skal opløses, og omskriv ligningen, hvor x repræsenterer antallet af hver ion.
- I dette eksempel skal vi omskrive ligningen 7,1 × 10 =
- Da der kun er en blyion (Pb) i forbindelsen, er antallet af opløste molekyler lig med antallet af frie blyioner. Derfor kan vi indstille det til x.
- Da der er to iodioner (I) for hver blyion, indstiller vi antallet af jodatomer lig med 2x.
- Nu bliver ligningen 7,1 × 10 = (x) (2x)
Tag eventuelle almindelige ioner i betragtning. Spring dette trin over, hvis du opløser forbindelsen i destilleret vand. Hvis en forbindelse opløses i en opløsning, der allerede har en eller flere bestanddele ("almindelige ioner"), vil opløseligheden af forbindelsen falde betydeligt. Virkningen af de generelle ioner vil være mest tydelig på næsten uopløselige forbindelser, og i dette tilfælde kan du antage, at de fleste ioner ved ligevægt er dem, der tidligere var i opløsning. Omskriv ligningen for at beregne molkoncentrationen (mol pr. Liter eller M) af de ioner, der allerede er i opløsningen, og erstatt denne værdi med den variabel x, du bruger til den ion.
- For eksempel, hvis blyjodidforbindelsen er opløst i 0,2 M blychlorid (PbCl) opløsning2), omskriver vi ligningen som 7.1 × 10 = (0.2M + x) (2x). Da 0,2 M er en højere koncentration end x, kan vi omskrive den til 7,1 × 10 = (0,2 M) (2x).
Løs ligningen. Løs for x, og du kender forbindelsens opløselighed. I definitionen af opløselighedskonstanten skal du skrive dit svar med hensyn til antallet af mol af forbindelsen opløst pr. Liter vand. Du skal muligvis bruge din computer til at finde det endelige svar.
- Det følgende eksempel er opløseligheden i destilleret vand uden nogen almindelige ioner.
- 7.1 × 10 = (x) (2x)
- 7.1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 mol pr. Liter opløses. Dette er en meget lille masse, så denne forbindelse er næsten uopløselig.
Hvad du har brug for
- Tabel over opløselighedsproduktkonstanter af forbindelsen (Ksp)
Råd
- Hvis du har eksperimentelle data om mængden af opløste forbindelser, kan du bruge den samme ligning til at løse opløselighedskonstanten K.sp.
Advarsel
- Der er ingen konsensus om definitionerne af disse termer, men kemikere er enige om størstedelen af forbindelserne. Et antal specielle forbindelser, hvor både opløselige og uopløselige molekyler udgør væsentlige bestanddele, hver med en forskellig beskrivelse af disse forbindelser.
- Nogle gamle lærebøger ser NH4OH er en opløselig forbindelse. Det er ikke sandt; Små mængder NH-ioner blev påvist4 og OH, men disse to ioner kan ikke kombineres til forbindelser.