Forfatter:
Eric Farmer
Oprettelsesdato:
10 Marts 2021
Opdateringsdato:
1 Juli 2024
Indhold
- Trin
- Metode 1 af 2: Bestemmelse af antallet af neutroner i atomer (ikke isotoper)
- Metode 2 af 2: Bestemmelse af antallet af neutroner i isotoper
- Tips
I atomer af det samme element er antallet af protoner konstant, mens antallet af neutroner kan variere.Ved at vide, hvor mange neutroner et bestemt atom indeholder, kan du afgøre, om det er et almindeligt atom eller en isotop, der vil have færre eller flere neutroner. Det er ganske enkelt at bestemme antallet af neutroner i et atom. Alt du skal gøre for at beregne antallet af neutroner i et atom eller en isotop er at følge vores instruktioner og holde det periodiske system ved hånden.
Trin
Metode 1 af 2: Bestemmelse af antallet af neutroner i atomer (ikke isotoper)
 1 Find elementet på det periodiske system. Som et eksempel vil vi overveje osmium (Os), som er i den sjette periode (sjette række fra toppen).
1 Find elementet på det periodiske system. Som et eksempel vil vi overveje osmium (Os), som er i den sjette periode (sjette række fra toppen).  2 Find elementets atomnummer. Dette er som regel det mest mærkbare tal i cellen i et element og er normalt placeret over dets symbol (i den version af det periodiske system, som vi bruger i vores eksempel, er der ingen andre tal). Atomnummeret er antallet af protoner i et atom af elementet. For osmium er dette tal 76, det vil sige, at der er 76 protoner i et osmiumatom.
2 Find elementets atomnummer. Dette er som regel det mest mærkbare tal i cellen i et element og er normalt placeret over dets symbol (i den version af det periodiske system, som vi bruger i vores eksempel, er der ingen andre tal). Atomnummeret er antallet af protoner i et atom af elementet. For osmium er dette tal 76, det vil sige, at der er 76 protoner i et osmiumatom. - Antallet af protoner er uændret, og det er det, der gør et element til et element.
 3 Find atomets masse af et element. Dette tal findes normalt under elementets symbol. Bemærk venligst, at atommassen ikke er angivet i versionen af det periodiske system i vores eksempel (dette er ikke altid tilfældet; i mange versioner af det periodiske system er atommassen angivet). Atommassen for osmium er 190,23.
3 Find atomets masse af et element. Dette tal findes normalt under elementets symbol. Bemærk venligst, at atommassen ikke er angivet i versionen af det periodiske system i vores eksempel (dette er ikke altid tilfældet; i mange versioner af det periodiske system er atommassen angivet). Atommassen for osmium er 190,23.  4 Rund atommassen til nærmeste hele tal. I vores eksempel afrundes 190,23 til 190.
4 Rund atommassen til nærmeste hele tal. I vores eksempel afrundes 190,23 til 190. - Atommasse er det gennemsnitlige antal isotoper af et bestemt element, normalt udtrykkes det ikke som et helt tal.
 5 Træk atomnummeret fra atommassen. Da protoner og neutroner tegner sig for den absolutte del af atommassen, fratrækker antallet af protoner (det vil sige atomnummeret, der er lig med antallet af protoner) fra atommassen antallet af neutroner i atomet. Tallene efter decimaltegnet refererer til den meget lille masse af elektroner i et atom. I vores eksempel: 190 (atomvægt) - 76 (antal protoner) = 114 (antal neutroner).
5 Træk atomnummeret fra atommassen. Da protoner og neutroner tegner sig for den absolutte del af atommassen, fratrækker antallet af protoner (det vil sige atomnummeret, der er lig med antallet af protoner) fra atommassen antallet af neutroner i atomet. Tallene efter decimaltegnet refererer til den meget lille masse af elektroner i et atom. I vores eksempel: 190 (atomvægt) - 76 (antal protoner) = 114 (antal neutroner).  6 Husk formlen. For at finde antallet af neutroner i fremtiden skal du blot bruge denne formel:
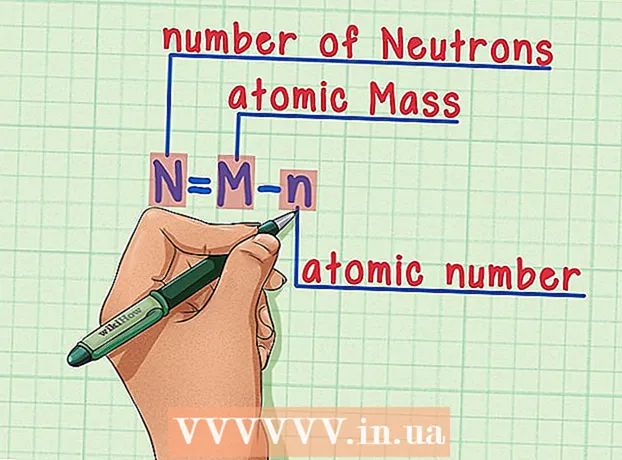
6 Husk formlen. For at finde antallet af neutroner i fremtiden skal du blot bruge denne formel: - N = M - n
- N = antal neutroner
- M = atommasse
- n = atomnummer
- N = M - n
Metode 2 af 2: Bestemmelse af antallet af neutroner i isotoper
 1 Find elementet på det periodiske system. Som et eksempel vil vi overveje isotopen af kulstof 14C. Da det ikke-isotopiske kulstof 14C bare er carbon C, skal du finde kulstof i det periodiske system (anden periode eller anden række fra toppen).
1 Find elementet på det periodiske system. Som et eksempel vil vi overveje isotopen af kulstof 14C. Da det ikke-isotopiske kulstof 14C bare er carbon C, skal du finde kulstof i det periodiske system (anden periode eller anden række fra toppen).  2 Find elementets atomnummer. Dette er som regel det mest mærkbare tal i cellen i et element og er normalt placeret over dets symbol (i den version af det periodiske system, som vi bruger i vores eksempel, er der ingen andre tal). Atomnummeret er antallet af protoner i et atom af elementet. Kulstof er nummer 6, hvilket betyder, at et kulstof har seks protoner.
2 Find elementets atomnummer. Dette er som regel det mest mærkbare tal i cellen i et element og er normalt placeret over dets symbol (i den version af det periodiske system, som vi bruger i vores eksempel, er der ingen andre tal). Atomnummeret er antallet af protoner i et atom af elementet. Kulstof er nummer 6, hvilket betyder, at et kulstof har seks protoner.  3 Find atommassen. I tilfælde af isotoper er dette meget let at gøre, da de er navngivet efter deres atommasse. I vores tilfælde har kulstof 14C en atommasse på 14. Nu kender vi isotopens atommasse; den efterfølgende beregningsproces er den samme som til bestemmelse af antallet af neutroner i atomer (ikke isotoper).
3 Find atommassen. I tilfælde af isotoper er dette meget let at gøre, da de er navngivet efter deres atommasse. I vores tilfælde har kulstof 14C en atommasse på 14. Nu kender vi isotopens atommasse; den efterfølgende beregningsproces er den samme som til bestemmelse af antallet af neutroner i atomer (ikke isotoper).  4 Træk atomnummeret fra atommassen. Da protoner og neutroner tegner sig for den absolutte del af atommassen, fratrækker antallet af protoner (det vil sige atomnummeret, der er lig med antallet af protoner) fra atommassen antallet af neutroner i atomet. I vores eksempel: 14 (atommasse) - 6 (antal protoner) = 8 (antal neutroner).
4 Træk atomnummeret fra atommassen. Da protoner og neutroner tegner sig for den absolutte del af atommassen, fratrækker antallet af protoner (det vil sige atomnummeret, der er lig med antallet af protoner) fra atommassen antallet af neutroner i atomet. I vores eksempel: 14 (atommasse) - 6 (antal protoner) = 8 (antal neutroner).  5 Husk formlen. For at finde antallet af neutroner i fremtiden skal du blot bruge denne formel:
5 Husk formlen. For at finde antallet af neutroner i fremtiden skal du blot bruge denne formel: - N = M - n
- N = antal neutroner
- M = atommasse
- n = atomnummer
- N = M - n
Tips
- Protoner og neutroner udgør næsten den absolutte masse af grundstoffer, mens elektroner og andre partikler udgør en ekstremt ubetydelig masse (denne masse har en tendens til nul).Da en proton har omtrent samme masse som en neutron, og atomnummeret er antallet af protoner, kan du ganske enkelt trække antallet af protoner fra den samlede masse.
- Osmium - et metal i fast tilstand ved stuetemperatur, fik sit navn fra det græske ord "osme" - lugt.
- Hvis du ikke er sikker på, hvad et tal i det periodiske system betyder, skal du huske: tabellen er normalt bygget op omkring et atomnummer (det vil sige antallet af protoner), der starter ved 1 (brint) og vokser en enhed fra venstre mod højre , der slutter med 118 (Oganesson). Dette skyldes, at antallet af protoner i et atom bestemmer selve elementet, og et sådant tal er den nemmeste måde at organisere elementerne på (f.eks. Er et atom med 2 protoner altid helium, ligesom et atom med 79 protoner altid er guld ).