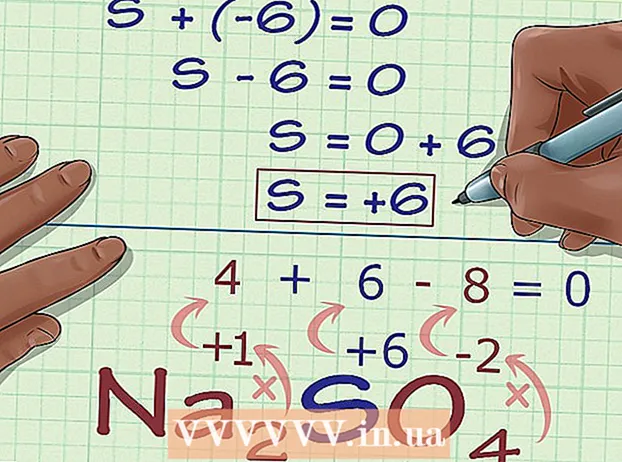
Indhold
- At træde
- Del 1 af 2: Tildeling af oxidationsnumre baseret på kemiske regler
- Del 2 af 2: Tildeling af tal til atomer uden reglerne for oxidationstal
- Tips
- Nødvendigheder
I kemi betyder udtrykkene "oxidation" og "reduktion" de reaktioner, hvor et atom (eller en gruppe af atomer) mister henholdsvis elektroner. Oxidationsnumre er tal tildelt atomer (eller grupper af atomer) for at hjælpe kemikere med at kontrollere, hvor mange elektroner der er tilgængelige til at blive fortrængt, og om givne reaktanter oxiderer eller reducerer under en reaktion. Processen med at tildele oxidationsnumre til atomer kan variere fra meget enkel til mere kompleks, afhængigt af atomernes ladning og den kemiske sammensætning af de molekyler, som de er en del af. For at gøre tingene mere komplicerede kan nogle atomer have flere oxidationsnumre. Heldigvis styres tildelingen af oxidationsnumre af klart definerede, let at følge regler, men en grundlæggende forståelse af kemi og algebra vil gøre det meget lettere at bruge disse regler.
At træde
Del 1 af 2: Tildeling af oxidationsnumre baseret på kemiske regler
 Find ud af, om det pågældende stof er elementært. Frie, ubundne atomer har altid et oxidationsnummer på 0. Dette gælder for både atomer, der består af et enkelt atom, og atomer, hvis grundform er diatomisk eller polyatomisk.
Find ud af, om det pågældende stof er elementært. Frie, ubundne atomer har altid et oxidationsnummer på 0. Dette gælder for både atomer, der består af et enkelt atom, og atomer, hvis grundform er diatomisk eller polyatomisk. - For eksempel Al(s) og Cl2 begge har oxidationsnummeret 0, fordi de ikke er sammensatte atomer.
- Bemærk, at svovl i sin grundform, S.8 (octasulfur), selvom det er uregelmæssigt, har også et oxidationsnummer på 0.
 Find ud af, om det pågældende stof er en ion. Ioner har oxidationstal svarende til deres ladning. Dette gælder både ubundne ioner og ioner, der er en del af en sammensat ion.
Find ud af, om det pågældende stof er en ion. Ioner har oxidationstal svarende til deres ladning. Dette gælder både ubundne ioner og ioner, der er en del af en sammensat ion. - F.eks. Har ionen Cl et oxidationstal på -1.
- Cl ion stadig har et oxidationstal på -1, når det er en del af forbindelsen NaCl. Da Na-ionen pr. Definition har en ladning på +1, ved vi, at Cl-ionen har en ladning på -1, så oxidationstallet stadig er -1.
 I tilfælde af metalioner er det godt at huske, at flere oxidationstal er mulige. Mange metaller kan have mere end en landing. For eksempel kan metaljernet (Fe) være en ion med ladning +2 eller +3. ladningen af metalioner (og dermed deres oxidationstal) kan bestemmes i forhold til ladningen af de andre atomer i sammensætningen, som de er en del af, eller, når de skrives som tekst, ved hjælp af notationen i romertal (såsom i sætningen: "Jern (III) ionen har en ladning på +3.").
I tilfælde af metalioner er det godt at huske, at flere oxidationstal er mulige. Mange metaller kan have mere end en landing. For eksempel kan metaljernet (Fe) være en ion med ladning +2 eller +3. ladningen af metalioner (og dermed deres oxidationstal) kan bestemmes i forhold til ladningen af de andre atomer i sammensætningen, som de er en del af, eller, når de skrives som tekst, ved hjælp af notationen i romertal (såsom i sætningen: "Jern (III) ionen har en ladning på +3."). - Lad os for eksempel se nærmere på en forbindelse, der indeholder en aluminiumion. Forbindelsen AlCl3 har en ladning på 0. Fordi vi ved, at Cl-ioner har en ladning på -1, og at 3 Cl-ioner er til stede i forbindelsen, skal Al-ionen have en ladning på +3, så ladningen af alle tilsatte ioner er 0. Så oxidationsnummeret på Al er +3.
 Tildel et oxidationsnummer -2 til ilt (med undtagelser). I næsten i alle tilfælde har iltatomer et oxidationsnummer på -2. Der er et par undtagelser fra denne regel:
Tildel et oxidationsnummer -2 til ilt (med undtagelser). I næsten i alle tilfælde har iltatomer et oxidationsnummer på -2. Der er et par undtagelser fra denne regel: - Når ilt er i elementær tilstand (O2), så er oxidationstallet lig med 0, hvilket er tilfældet for alle elementære atomer.
- Når ilt er en del af peroxid, så er oxidationstallet -1. Peroxider er en klasse af forbindelser, der har en oxygen-oxygenbinding (eller peroxidanionen O2). For eksempel i molekylet H2O2 (hydrogenperoxid), har ilt et oxidationsnummer (og en ladning) på -1. Når ilt er en del af et superoxid, er oxidationstallet også -0,5.
- Når ilt er bundet til fluor, er oxidationstallet +2. Se fluorreglen nedenfor for mere information. I (O2F.2) dette er +1.
 Tildel et oxidationsnummer på +1 til brint (med undtagelser). Som med ilt afhænger oxidationsantalet af brint af ekstraordinære tilfælde. Generelt har hydrogen et oxidationstal +1 (undtagen i elementær form H.2). Men i tilfælde af en speciel forbindelse kaldet hybrider har hydrogen et oxidationsnummer på -1.
Tildel et oxidationsnummer på +1 til brint (med undtagelser). Som med ilt afhænger oxidationsantalet af brint af ekstraordinære tilfælde. Generelt har hydrogen et oxidationstal +1 (undtagen i elementær form H.2). Men i tilfælde af en speciel forbindelse kaldet hybrider har hydrogen et oxidationsnummer på -1. - For eksempel fra H2Åh, vi ved, at brint har et oxidationsnummer på +1, fordi ilt har en ladning på -2, og vi har brug for 2 +1 ladninger for at fremstille en forbindelse med en samlet ladning på nul. Men med stoffet natriumhydrid, NaH, har hydrogen et oxidationsnummer -1, fordi Na-ionen har en ladning på +1, og for at gøre den samlede ladning af forbindelsen 0 har hydrogen en ladning (og dermed et oxidationsnummer) på -1.
 Fluor altid et oxidationstal på -1. Som angivet ovenfor kan oxidationsnumrene for visse grundstoffer variere på grund af forskellige faktorer (metalioner, iltatomer i peroxider osv.). Fluor har derimod et oxidationsnummer på -1, og det ændrer sig aldrig. Dette skyldes, at fluor er det mest elektro-negative element, eller med andre ord, det er det element, der er mindst villig til at opgive elektroner og mest sandsynligt overtager elektroner fra andre atomer. Derfor ændres oxidationsnummeret ikke.
Fluor altid et oxidationstal på -1. Som angivet ovenfor kan oxidationsnumrene for visse grundstoffer variere på grund af forskellige faktorer (metalioner, iltatomer i peroxider osv.). Fluor har derimod et oxidationsnummer på -1, og det ændrer sig aldrig. Dette skyldes, at fluor er det mest elektro-negative element, eller med andre ord, det er det element, der er mindst villig til at opgive elektroner og mest sandsynligt overtager elektroner fra andre atomer. Derfor ændres oxidationsnummeret ikke.  Oxidationstallene i en forbindelse er lig med forbindelsens ladning. Oxidationstallene for alle atomer i en forbindelse er lig med ladningen af den forbindelse. For eksempel, hvis en forbindelse ikke har nogen ladning, vil summen af alle oxidationstal være nul; hvis forbindelsen er en polyatomisk ion med en ladning på -1, skal de tilsatte oxidationstal være -1 osv.
Oxidationstallene i en forbindelse er lig med forbindelsens ladning. Oxidationstallene for alle atomer i en forbindelse er lig med ladningen af den forbindelse. For eksempel, hvis en forbindelse ikke har nogen ladning, vil summen af alle oxidationstal være nul; hvis forbindelsen er en polyatomisk ion med en ladning på -1, skal de tilsatte oxidationstal være -1 osv. - Dette er en god måde at kontrollere dit svar på - hvis det tilsatte oxidationsnummer for en forbindelse ikke svarer til ladningen af den forbindelse, så ved du, at du har lavet en fejl.
Del 2 af 2: Tildeling af tal til atomer uden reglerne for oxidationstal
 Find atomer uden oxidationsnummerregler. Nogle atomer følger ikke reglerne for at finde oxidationsnumre. Hvis et atom ikke overholder ovenstående regler, og du ikke er sikker på, hvad dets ladning er (for eksempel hvis det er en del af en større forbindelse, så den individuelle ladning er ukendt), kan du finde oxidationsnummeret på det atom ved eliminering. Først bestemmer du, hvad oxidationen er af hvert andet atom i forbindelsen. Derefter løser du summen for det ukendte i ligningen baseret på den samlede ladning af forbindelsen.
Find atomer uden oxidationsnummerregler. Nogle atomer følger ikke reglerne for at finde oxidationsnumre. Hvis et atom ikke overholder ovenstående regler, og du ikke er sikker på, hvad dets ladning er (for eksempel hvis det er en del af en større forbindelse, så den individuelle ladning er ukendt), kan du finde oxidationsnummeret på det atom ved eliminering. Først bestemmer du, hvad oxidationen er af hvert andet atom i forbindelsen. Derefter løser du summen for det ukendte i ligningen baseret på den samlede ladning af forbindelsen. - For eksempel i forbindelsen Na2SÅ4, ladningen af svovl (S) er ukendt - den er ikke i sin grundform, så den er ikke 0, men det er alt, hvad vi ved. Dette er en god kandidat til at anvende denne metode til at bestemme oxidationsnummeret algebraisk.
 Bestem de kendte oxidationsnumre for de andre grundstoffer i forbindelsen. Ved hjælp af reglerne for tildeling af oxidationsnummer bestemmer vi, hvilke oxidationsnumre de andre atomer i forbindelsen har. Vær opmærksom på undtagelser som O, H osv.
Bestem de kendte oxidationsnumre for de andre grundstoffer i forbindelsen. Ved hjælp af reglerne for tildeling af oxidationsnummer bestemmer vi, hvilke oxidationsnumre de andre atomer i forbindelsen har. Vær opmærksom på undtagelser som O, H osv. - I Na2SÅ4, vi ved, baseret på vores regelsæt, at Na-ionen har en ladning (og dermed et oxidationsnummer) på +1, og at iltatomerne har oxidationstal på -2.
 Multiplicer antallet af hvert atom med oxidationsnummeret. Nu hvor vi kender oxidationstallene for alle atomer undtagen det ukendte, bliver vi nødt til at overveje, at nogle af disse atomer kan forekomme mere end én gang. Multiplicer hver koefficient (skrevet i abonnement efter atomets symbol i forbindelsen) med oxidationsnummeret.
Multiplicer antallet af hvert atom med oxidationsnummeret. Nu hvor vi kender oxidationstallene for alle atomer undtagen det ukendte, bliver vi nødt til at overveje, at nogle af disse atomer kan forekomme mere end én gang. Multiplicer hver koefficient (skrevet i abonnement efter atomets symbol i forbindelsen) med oxidationsnummeret. - Hvad angår Na2SÅ4, vi ved, at der er 2 Na-atomer og 4 O-atomer. Nu foretager vi følgende beregning, 2 × +1, for at få oxidationsnummeret af Na, 2, og vi ganger 4 × -2, oxidationsantalet O, -8.
 Tilføj resultaterne. Tilføjelse af resultaterne af disse multiplikationer giver oxidationsnummeret på forbindelsen, uden under hensyntagen til oxidationsnummeret for det ukendte atom.
Tilføj resultaterne. Tilføjelse af resultaterne af disse multiplikationer giver oxidationsnummeret på forbindelsen, uden under hensyntagen til oxidationsnummeret for det ukendte atom. - I vores eksempel med Na2SÅ4, vi tilføjer 2 til -8 for at få -6.
 Beregn det ukendte oxidationsnummer baseret på forbindelsens ladning. Du har nu alle data til at finde det ukendte oxidationsnummer ved hjælp af en simpel algebra. Vi bruger en ligning og svaret fra det foregående trin plus opladningen af forbindelsen. Med andre ord: (Summen af de ukendte oxidationsnumre) + (det ukendte oxidationsnummer, du vil vide) = (ladning af forbindelsen).
Beregn det ukendte oxidationsnummer baseret på forbindelsens ladning. Du har nu alle data til at finde det ukendte oxidationsnummer ved hjælp af en simpel algebra. Vi bruger en ligning og svaret fra det foregående trin plus opladningen af forbindelsen. Med andre ord: (Summen af de ukendte oxidationsnumre) + (det ukendte oxidationsnummer, du vil vide) = (ladning af forbindelsen).- I eksemplet med Na2SÅ4, løser vi dette som følger:
- (Summen af kendte oxidationsnumre) + (ukendt oxidationsnummer, du vil løse) = (ladning af forbindelsen)
- -6 + S = 0
- S = 0 + 6
- S = 6. S har et oxidationsnummer eller 6 i Na2SÅ4.
- I eksemplet med Na2SÅ4, løser vi dette som følger:
Tips
- Atomer i deres grundlæggende form har altid et oxidationsnummer på 0. En ion, der består af 1 atom, har et oxidationsnummer svarende til ladningen. Gruppe 1A-metaller såsom hydrogen, lithium og natrium har et oxidationsnummer +1; Gruppe 2A-metaller, såsom magnesium og calcium, har et oxidationsnummer på +2. Både brint og ilt kan have 2 forskellige oxidationsnumre afhængigt af deres binding.
- I en forbindelse skal summen af alle oxidationstal være lig med 0. Hvis der er en ion med 2 atomer, skal summen af oxidationstallene være lig med ionens ladning.
- Det er meget nyttigt at vide, hvordan man læser det periodiske system, og hvor man finder metaller og ikke-metaller.
Nødvendigheder
- Periodisk system af elementerne
- En internetforbindelse
- En kemibog
- Papir, pen eller blyant
- Lommeregner