Forfatter:
Louise Ward
Oprettelsesdato:
11 Februar 2021
Opdateringsdato:
1 Juli 2024

Indhold
Størrelsen på et atom er så lille, at det er svært at måle nøjagtigt atomnummeret på en kemisk forbindelse. For at være i stand til nøjagtigt at måle en mængde stoffer bruger forskere en molenhed til at repræsentere et specificeret antal atomer. En mol stof defineres som ækvivalent med antallet af kulstofatomer indeholdt i 12 gram kulstofisotop, hvilket er ca. 6.022 x 10 atomer. Denne værdi kaldes Avogadro-nummeret eller Avogadro-konstanten. Dette kaldes også antallet af atomer i 1 mol af ethvert element, og 1 mol af massen af et stof kaldes det molære masse af det stof.
Trin
Metode 1 af 2: Beregn et molers masse af et element
Definition af molær masse. Molemasse af et stof er massen (i gram) af et mol af dette stof. For at beregne den molære masse af et element multipliceres dets atommasse med gram-per-mol-konverteringsfaktoren (g / mol).
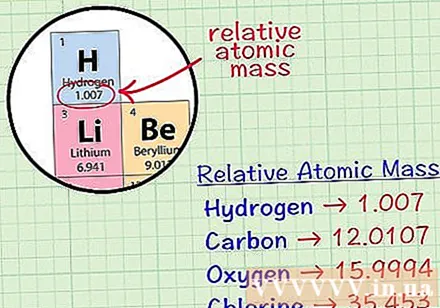
Find det gennemsnitlige kubiske atom for et element. Det gennemsnitlige masseatom for et element er den gennemsnitlige masse i atomenheder i en prøve, der inkluderer alle isotoperne af dette element. Disse oplysninger gives ofte i det periodiske system. Ved at finde et element kan du finde et gennemsnitligt kubisk atom skrevet lige under elementets kemiske symbol. Denne værdi er ikke et heltal, men et tal med decimaler.- For eksempel med hydrogen er det gennemsnitlige masseatom 1,007; Det gennemsnitlige kubiske atom af kulstof er 12.0107; Det gennemsnitlige iltatom af ilt er 15.9994; klor har en gennemsnitlig atommasse på 35.453.

Multiplicer det gennemsnitlige masseatom med den molære massekonstant. Enheden molær glidning er defineret som 0,001 kg pr. Mol eller 1 gram pr. Mol. Produktet af det gennemsnitlige masseatom og molmassekonstanten konverterer enheden med atommasse til gram pr. Mol, så molmassen af brint vil være 1,007 gram pr. Mol, for kulstof er det 12 0107 gram pr. Mol ilt er 15.9995 gram pr. Mol og klor er 35.453 gram pr. Mol.- Nogle elementer findes i naturen som molekyler, der består af to eller flere af de samme atomer. Det vil sige, hvis du vil beregne molmassen af forbindelser, der består af mere end et atom, såsom hydrogengas, iltgas eller klorgas, skal du bestemme den gennemsnitlige atommasse af forbindelsen og multiplicere denne værdi. med den molære masse konstant, '' så '' gang det produkt, du lige har fundet, med 2.
- Med H2: 1.007 x 2 = 2.014 gram pr. Mol; for O2: 15,9994 x 2 = 31,9988 gram pr. Mol; og Cl2: 35,453 x 2 = 70,096 gram pr. Mol.
Metode 2 af 2: Beregn den molære masse af forbindelsen

Bestem strukturens formel for forbindelsen. Strukturens strukturformel giver atomnummeret for hvert element, der udgør den forbindelse. (Denne information findes i alle referencebøger). For eksempel er den kemiske formel for saltsyre HCI; af glucose er C6H12O6. Med denne strukturformel kan vi bestemme antallet af hver type atom, der udgør den pågældende forbindelse.- Hvor HCI har et hydrogenatom og et chloratom.
- Glukosesukkermolekyle C6H12O6 har 6 carbonatomer, 12 hydrogenatomer og 6 oxygenatomer.
Bestem det gennemsnitlige masseatom for hvert bestanddel. Brug det periodiske system til at finde det gennemsnitlige masseatom for hvert element, der er til stede i forbindelsen. Det gennemsnitlige masseatom er normalt skrevet under elementets kemiske symbol på det periodiske system. Svarende til beregning af molmassen for et element multipliceres det gennemsnitlige masseatom med 1 gram / mol.
- Det gennemsnitlige masseatom for de grundstoffer, der danner saltsyre, er som følger: hydrogen 1.007 g / mol og chlor 35.453 g / mol.
- Det gennemsnitlige masseatom for de grundstoffer, der udgør glukosemolekylet, er: kulstof, 12.017 g / mol; hydrogen, 1.007 g / mol; og ilt, 15,9995 g / mol.
Beregn molmassen for hvert komponentelement. Multiplicering af et grundstofs masseatom med antallet af atomer, det bidrager i en forbindelse, giver den gennemsnitlige masse af elementet i forbindelsen.
- I tilfælde af saltsyre, HCI, er molmassen af elementet hydrogen 1.007 g / mol, og massen af chlor er 35.453 g / mol.
- I tilfælde af glukose er C6H12O6, den molære masse for hvert element er som følger: kulstof, 12,0107 x 6 = 72,0642 g / mol; hydrogen, 1.007 x 12 = 12.084 g / mol; ilt, 15.9995 x 6 = 95.9964 g / mol.
Samlet molær masse af bestanddelene. Den samlede molære masse af komposteringselementerne er den molære masse af forbindelsen.I det forrige trin beregnede vi den molære masse af hvert element, der er til stede i forbindelsen, i dette trin skal vi bare tilføje alle disse værdier sammen.
- Molmasse saltsyre er 1.007 + 35.453 = 36.460 g / mol. 36,46 gram er massen af 1 mol saltsyre.
- Molær masse af glukose er 72.0642 + 12.084 + 95.9964 = 180.1466 g / mol. Så hver mol glukose har en masse på 180,14 gram.
Råd
- Selv om det gennemsnitlige masseatom i de fleste tilfælde registreres til den nærmeste 1 del 1000 (4 decimaler), reduceres molmassen ofte i laboratorier i laboratorier til 2 decimaler, undertiden endnu mindre for store molekyler. Derfor kan molmassen af saltsyre i laboratoriesagen skrives til 36,46 gram pr. Mol for glukose 180,14 gram pr. Mol.
Hvad du har brug for
- Kemisk referencebog eller periodisk system af grundstoffer
- Computer