Forfatter:
Lewis Jackson
Oprettelsesdato:
8 Kan 2021
Opdateringsdato:
25 Juni 2024
Indhold
Netionligningen er en vigtig del af kemien, fordi den kun repræsenterer de partikler, der ændrer sig i en kemisk reaktion. De bruges mest i oxidationsreduktionsreaktioner, metaboliske reaktioner og neutraliseringsreaktioner af syrer - baser. Der er tre grundlæggende trin til at skrive en nettoionligning: afbalancere den molekylære ligning, konvertere den til den fulde ionlige ligning (hvordan hvert stof eksisterer i opløsning) og til sidst skrive nettoionligningen.
Trin
Del 1 af 2: Forstå komponenterne i den ioniske ligning
Kend forskellen mellem molekyler og ioniske forbindelser. Det første trin i at skrive en nettoionligning er at bestemme de ioniske forbindelser i reaktionen. Ioniske forbindelser er dem, der adskiller ioner i en vandig opløsning og har en elektrisk ladning. Molekylære forbindelser er forbindelser, der aldrig har en elektrisk ladning. De dannes mellem to ikke-metaller og kaldes undertiden kovalente forbindelser.
- Ioniske forbindelser kan dannes mellem metaller og ikke-metaller, metaller og polyatomiske ioner eller flere polyatomiske ioner.
- Hvis du er usikker på, hvad forbindelsen er, kan du se efter elementerne i den forbindelse i det periodiske system.

Genkend opløseligheden af en forbindelse. Ikke alle ioniske forbindelser er opløselige i vandig opløsning og kan derfor ikke adskilles i ioner. Du skal identificere opløseligheden af hver forbindelse, inden du fortsætter med resten af ligningen. Nedenfor er et resumé af reglerne for opløselighed. Find et opløselighedsark for mere detaljerede oplysninger og undtagelser fra disse regler.- Følg disse regler i nedenstående rækkefølge:
- Alle Na-, K- og NH-salte4 alle opløses.
- Alle INGEN salte3, C2H3O2ClO3og ClO4 alle smelter.
- Alle Ag-, Pb- og Hg-salte2 alle smelter.
- Alle Cl-, Br- og I-salte er opløselige.
- Alle CO-salte3, O, S, OH, PO4, CrO4, Cr2O7, også3 er opløst (undtagen i nogle få tilfælde).
- Alle SO-salte4 er opløst (undtagen i nogle få tilfælde).
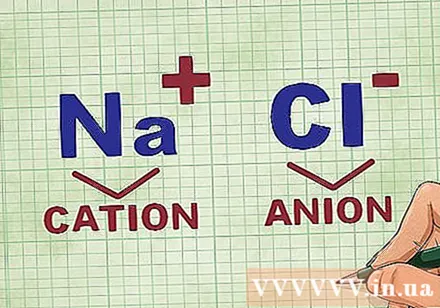
Bestemmelse af kationer og anioner i en forbindelse. Kationer er de positive ioner i en forbindelse og er normalt metallet. Anionen er den negative ion i forbindelsen og er ikke-metallisk. Nogle ikke-metaller kan danne kationer, men metaller danner altid kationer.- For eksempel i NaCl er Na den positivt ladede kation, fordi den er et metal, og Cl er den negativt ladede anion, fordi den er ikke-metal.

Genkend polyatomiske ioner i reaktionen. Polyatomiske ioner er ladede molekyler, der er tæt bundet sammen og ikke adskiller sig under kemiske reaktioner. Det er vigtigt at genkende polyatomiske ioner, fordi de har en bestemt ladning og ikke adskiller sig. Polyatomiske ioner kan have en positiv eller negativ ladning.- Hvis du studerer generel kemi, er det ofte nødvendigt at huske nogle almindelige polyatomiske ioner.
- Nogle almindelige polyatomiske ioner er CO3, NEJ3, NEJ2, SÅ4, SÅ3ClO4 og ClO3.
- Du kan også finde mange andre ioner i kemibøger eller på internettet.
Del 2 af 2: Skrivning af en netionisk ligning
Balance molekylære ligninger. Inden du skriver en netionisk ligning, skal du sikre dig, at din molekylære ligning er afbalanceret. For at afbalancere ligningen tilføjer du koefficienter foran forbindelsen, så atomnummeret for hvert element er lig på begge sider af ligningen.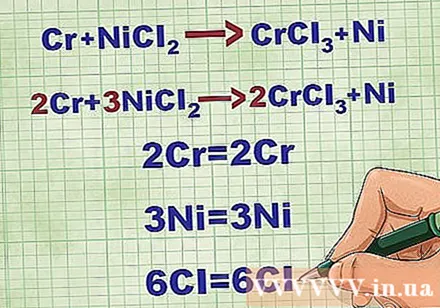
- Skriv ned antallet af atomer, der udgør hver forbindelse på begge sider af ligningen.
- Tilføj en koefficient foran andre elementer end ilt og brint for at afbalancere hver side.
- Hydrogenatombalance.
- Oxygenatomisk balance.
- Fortæl antallet af atomer på hver side af ligningen for at sikre, at de er afbalancerede.
- For eksempel Cr + NiCl2 -> CrCl3 + Ni Balanceret til 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Identificer tilstanden af forbindelsen i ligningen. Mange gange i problemet er der nøgleord, der fortæller dig tilstanden af hver forbindelse. Der er flere regler, der hjælper med at bestemme tilstanden for et element eller en forbindelse.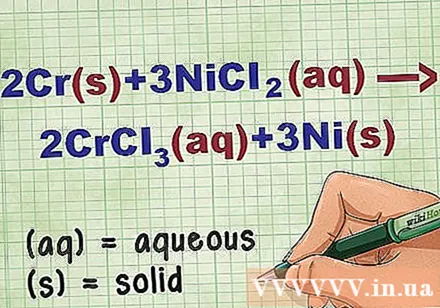
- Hvis tilstanden for et element ikke er angivet, skal du bruge den tilstand, der findes i det periodiske system.
- Hvis forbindelsen kaldes en opløsning, kan du skrive den som vandig eller (dd).
- Hvis der er vand i ligningen, skal du afgøre, om den ioniske forbindelse er vandopløselig ved hjælp af opløselighedsregnearket. Hvis opløseligheden er høj, vil forbindelsen være vandig (dd), hvis opløseligheden er lav, vil forbindelsen være fast (r).
- Uden vand er den ioniske forbindelse fast (r).
- Hvis problemet er surt eller basisk, er forbindelsen vandig (dd).
- For eksempel 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. De grundlæggende former for Cr og Ni er i fast tilstand. NiCl2 og CrCl3 ioniske forbindelser er opløselige, så de er vandige. Omskriv ligningen som: 2Cr(r) + 3 NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
Bestem, hvilke forbindelser der skal dissocieres (dissocieres i kationer og anioner) i opløsning. Når et stof eller en forbindelse dissocieres, adskiller det sig i en positivt ladet ion (kation) og en negativt ladet ion (anion). Dette er de komponenter, der ækvilibreres i slutningen af nettoionligningen.
- Faste stoffer, væsker, gasser, molekylære forbindelser, ioniske forbindelser med lav opløselighed, polyatomiske ioner og svage syrer adskiller sig ikke.
- Ioniske forbindelser har en høj opløselighed (brug opløselighedstabellen), og stærke syrer ioniserer 100% (HCI(dd), HBr(dd), HEJ(dd), H2SÅ4(dd)HClO4(dd)og HNO3(dd)).
- Bemærk, selvom polyatomiske ioner ikke adskiller sig mere, hvis de er bestanddele af denne forbindelse, adskiller de sig fra forbindelsen.
Beregn ladningen for hver ion, der er adskilt fra forbindelsen. Husk, at metaller vil danne positive ioner, og ikke-metaller vil danne negative ioner. Brug det periodiske system til at bestemme et elements ladning. Du skal også afbalancere ladningen af hver ion i forbindelsen.
- I dette eksempel NiCl2 adskilt i Ni og Cl, mens CrCl3 opdelt i Cr og Cl.
- Ni har en ladning på 2+, fordi Cl har en negativ ladning på en, men har 2 atomer. Derfor skal vi afbalancere de 2 negative Cl-ioner. Cr har 3+ opladning, så vi er nødt til at afbalancere de 3 negative Cl-ioner.
- Husk, at polyatomiske ioner har en bestemt ladning.
Skriv den komplette ionlige ligning ned. Alt, der adskiller eller ioniserer (stærke syrer) adskilles i to separate ioner. Stoffets tilstand er stadig (dd), men sørg for, at ligningen forbliver afbalanceret.
- Faste stoffer, væsker, gasser, svage syrer og ioniske forbindelser med lav opløselighed ændrer ikke tilstand eller adskilles i ioner. Vi holder dem intakte.
- Molekylære stoffer spredes i opløsning, så deres tilstand ændres til (dd). Tre undtagelser er ikke blive (dd) er: CH4(k), C3H8(k)og C8H18(l).
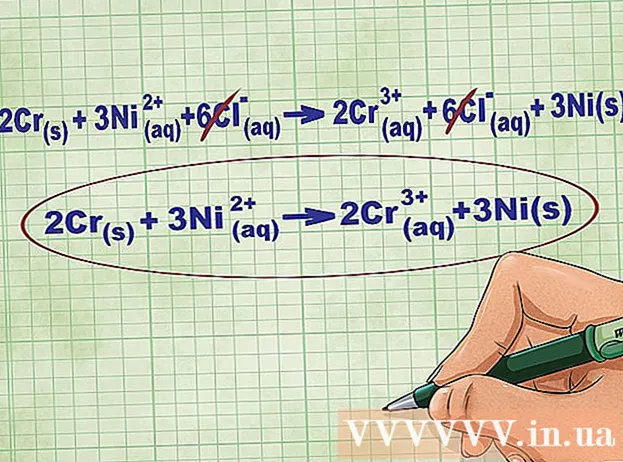
- Fortsat med ovenstående eksempel ser den fulde ionlige ligning sådan ud: 2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(r). Når Cl ikke er i en forbindelse, er det ikke en bipolar, så vi ganger faktoren med antallet af atomer i forbindelsen for at få 6 Cl-ioner på begge sider af ligningen.
Fjern ligevægtsionerne ved at fjerne de samme ioner på hver side af ligningen. Du kan kun annullere, hvis de er nøjagtigt de samme på begge sider (ladning, atomnummer osv.). Omskriv ligningen uden de destruerbare stoffer.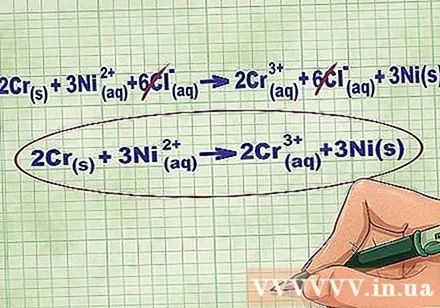
- Efter at have gennemført eksemplet har vi 6 annullerbare Cl-ligevægtsioner på hver side. Netionisk ligning er 2Cr(r) + 3Ni(dd) -> 2Cr(dd) + 3Ni(r).
- Hvis du har ret, skal den samlede ladning på reaktantsiden være lig med den samlede ladning på produktsiden i nettoionligningen.
Råd
- Skriv tilstandene for alle stoffer i ligningen, hvis ikke dig vilje tabe point.



