Forfatter:
Helen Garcia
Oprettelsesdato:
17 April 2021
Opdateringsdato:
1 Juli 2024
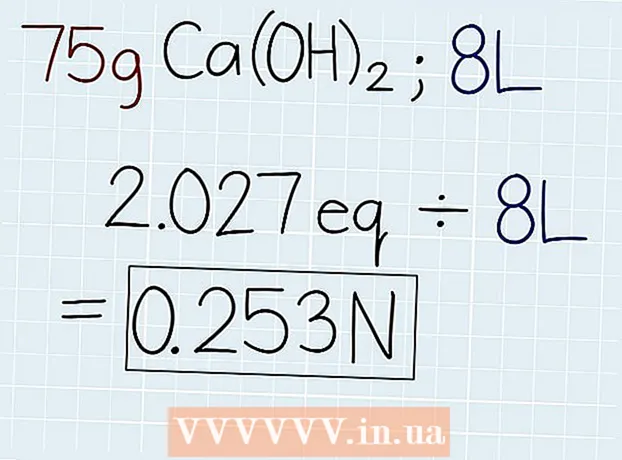
Indhold
- Trin
- Metode 1 af 2: Beregning af normalitet via molaritet
- Metode 2 af 2: Beregning af normalitet i ækvivalent masse
- Tips
- Hvad har du brug for
Normalitet angiver koncentrationen af syre eller alkali i en opløsning. For at finde ud af normaliteten af en opløsning kan både molaritet og molekylets ækvivalente masse bruges i beregningerne. Hvis du vælger at bruge molaritet, skal du bruge formlen N = M (n), hvor M er molaritet og n er antallet af hydrogen- eller hydroxidmolekyler. Hvis du beslutter dig for at bruge den ækvivalente masse, skal du bruge formlen N = eq ÷ V, hvor eq er antallet af ækvivalenter og V er opløsningens volumen.
Trin
Metode 1 af 2: Beregning af normalitet via molaritet
 1 Tilføj molmassen af alle komponenterne i opløsningen. Find elementerne i den kemiske formel på det periodiske system for at finde ud af deres atommasse, som svarer til molmassen. Skriv molarmassen for hvert element ned og gang det med antallet af disse elementer. Tilføj molmassen af alle komponenter for at finde den samlede molære masse.
1 Tilføj molmassen af alle komponenterne i opløsningen. Find elementerne i den kemiske formel på det periodiske system for at finde ud af deres atommasse, som svarer til molmassen. Skriv molarmassen for hvert element ned og gang det med antallet af disse elementer. Tilføj molmassen af alle komponenter for at finde den samlede molære masse. - For eksempel, hvis du vil kende den molære masse af svovlsyre (H2SÅ4), find ud af molmassen af brint (1 g), svovl (3 g) og ilt (16 g).
- Gang massen med antallet af komponenter i sammensætningen. I vores eksempel er der 2 brintatomer og 4 iltatomer. Den samlede molmasse af hydrogen er 2 x 1 g = 2 g. Molmassen af ilt i denne opløsning vil være 4 x 16 g = 64 g.
- Tilsæt alle molære masser sammen. Du får 2 g + 32 g + 64 g = 98 g / mol.
- Hvis du allerede kender molariteten i den løsning, du leder efter, skal du gå direkte til trin 4.
 2 Opdel den faktiske masse af opløsningen med molmassen. Find ud af løsningens faktiske vægt. Det vil blive angivet enten på beholderen med løsningen eller i selve opgaven.Derefter divideres opløsningens masse med den samlede molmasse, der blev fundet tidligere. Resultatet vil være antallet af mol i opløsningen, hvorefter "mol" skal skrives.
2 Opdel den faktiske masse af opløsningen med molmassen. Find ud af løsningens faktiske vægt. Det vil blive angivet enten på beholderen med løsningen eller i selve opgaven.Derefter divideres opløsningens masse med den samlede molmasse, der blev fundet tidligere. Resultatet vil være antallet af mol i opløsningen, hvorefter "mol" skal skrives. - For eksempel, hvis du forsøger at finde ud af normaliteten af 100 g H2SÅ4opløst i 12 liter væske, brug den faktiske masse og divider med molær. Som et resultat får du: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 mol er lig med 6,02 x 10 atomer eller molekyler af en opløsning.
 3 Opdel resultatet med opløsningens volumen i liter for at finde ud af molariteten. Tag antallet af mol i opløsningen, der lige er beregnet, og divider den med det samlede volumen af opløsningen, der skal måles. Som et resultat kender du molariteten (M), hvormed du kan finde opløsningens koncentration.
3 Opdel resultatet med opløsningens volumen i liter for at finde ud af molariteten. Tag antallet af mol i opløsningen, der lige er beregnet, og divider den med det samlede volumen af opløsningen, der skal måles. Som et resultat kender du molariteten (M), hvormed du kan finde opløsningens koncentration. - Baseret på vores eksempel får vi følgende formel: 1,02 mol ÷ 12 L = 0,085 M.
Råd: Sørg for at konvertere opløsningens volumen til liter, hvis du ikke allerede har gjort det. Ellers får du det forkerte svar.
 4 Multiplicer molariteten med antallet af hydrogen- eller hydroxidmolekyler. Tag et kig på den kemiske formel for at finde ud af antallet af hydrogenatomer (H) i en syre eller hydroxidmolekyler i (OH) i basen. Derefter multipliceres opløsningens molaritet med antallet af hydrogen- eller hydroxidmolekyler i denne opløsning for at finde den normale koncentration eller normalitet. I slutningen af dit svar skal du skrive forkortelsen "N".
4 Multiplicer molariteten med antallet af hydrogen- eller hydroxidmolekyler. Tag et kig på den kemiske formel for at finde ud af antallet af hydrogenatomer (H) i en syre eller hydroxidmolekyler i (OH) i basen. Derefter multipliceres opløsningens molaritet med antallet af hydrogen- eller hydroxidmolekyler i denne opløsning for at finde den normale koncentration eller normalitet. I slutningen af dit svar skal du skrive forkortelsen "N". - I vores eksempel er svovlsyre (H2SÅ4) 2 hydrogenatomer. Så formlen vil være sådan: 0,085 M x 2 = 0,17 N.
- I et andet eksempel har natriumhydroxid (NaOH) med en molaritet på 2 M kun 1 hydroxidmolekyle. Derfor vil formlen være som følger: 2 M x 1 = 2 N.
Metode 2 af 2: Beregning af normalitet i ækvivalent masse
 1 Find ud af den samlede molære masse af opløsningen. Tag et kig på opløsningens kemiske formel og find hvert element i det periodiske system. Skriv den molære masse af hvert element ned og gang det med antallet af disse elementer i formlen. Tilføj alle molære masser sammen for at finde den samlede molære masse i gram.
1 Find ud af den samlede molære masse af opløsningen. Tag et kig på opløsningens kemiske formel og find hvert element i det periodiske system. Skriv den molære masse af hvert element ned og gang det med antallet af disse elementer i formlen. Tilføj alle molære masser sammen for at finde den samlede molære masse i gram. - For eksempel, hvis du vil kende molmassen af Ca (OH)2, find derefter molmassen af calcium (40 g), ilt (16 g) og hydrogen (1 g) ud.
- I formlen er der 2 atomer af ilt og hydrogen. Den samlede iltmasse vil være: 2 x 16 g = 32 g. Molens masse af brint vil være: 2 x 1 g = 2 g.
- Tilføj alle molmasser for at få 40 g + 32 g + 2 g = 74 g / mol.
 2 Divider molmassen med antallet af hydrogen- eller hydroxidmolekyler. Find ud af antallet af hydrogenatomer (H) i en syre eller hydroxid (OH) molekyler i basen. Opdel den samlede molmasse, der netop er opnået med antallet af atomer eller molekyler for at finde vægten af 1 ækvivalent, som vil være lig med massen af 1 mol hydrogen eller hydroxid. I slutningen af svaret skal du skrive forkortelsen "G.-e.", hvilket betyder massen af ækvivalent.
2 Divider molmassen med antallet af hydrogen- eller hydroxidmolekyler. Find ud af antallet af hydrogenatomer (H) i en syre eller hydroxid (OH) molekyler i basen. Opdel den samlede molmasse, der netop er opnået med antallet af atomer eller molekyler for at finde vægten af 1 ækvivalent, som vil være lig med massen af 1 mol hydrogen eller hydroxid. I slutningen af svaret skal du skrive forkortelsen "G.-e.", hvilket betyder massen af ækvivalent. - I vores eksempel er Ca (OH)2 2 to brintmolekyler, hvilket betyder, at massen af ækvivalent vil være lig med 74 g / mol ÷ 2 = 37 G.-e.
 3 Opdel den faktiske vægt af opløsningen med den tilsvarende vægt. Når du kender massen af ækvivalent, divideres den med massen af opløsningen, som er angivet på beholderen med løsningen eller i problemet, der skal løses. Svaret vil være antallet af ækvivalenter i løsningen, så du derefter kan beregne normaliteten. I slutningen af svaret skal du sætte forkortelsen "e."
3 Opdel den faktiske vægt af opløsningen med den tilsvarende vægt. Når du kender massen af ækvivalent, divideres den med massen af opløsningen, som er angivet på beholderen med løsningen eller i problemet, der skal løses. Svaret vil være antallet af ækvivalenter i løsningen, så du derefter kan beregne normaliteten. I slutningen af svaret skal du sætte forkortelsen "e." - Hvis i vores eksempel 75 g Ca (OH)2, så vil formlen være som følger: 75 g ÷ 37 G.-e = 2,027 Oe.
 4 Divider antallet af ækvivalenter med mængden af opløsning i liter. Find ud af det samlede volumen af løsningen og skriv svaret ned i liter. Tag det antal ækvivalenter, der lige er opnået, og divider med opløsningens volumen for at finde ud af normaliteten. I slutningen af dit svar skal du sætte en forkortelse "N".
4 Divider antallet af ækvivalenter med mængden af opløsning i liter. Find ud af det samlede volumen af løsningen og skriv svaret ned i liter. Tag det antal ækvivalenter, der lige er opnået, og divider med opløsningens volumen for at finde ud af normaliteten. I slutningen af dit svar skal du sætte en forkortelse "N". - Hvis der er 75 g Ca (OH) i en opløsning med et volumen på 8 liter2, divider derefter antallet af ækvivalenter med volumen på følgende måde: 2.027 Oe. ÷ 8 l = 0,253 N.
Tips
- Normal koncentration eller normalitet bruges ofte til at måle syrer og baser. Hvis du skal bestemme koncentrationen af en anden opløsning, gøres dette normalt ved at måle molariteten.
Hvad har du brug for
- Periodiske system
- Lommeregner



