Forfatter:
Lewis Jackson
Oprettelsesdato:
5 Kan 2021
Opdateringsdato:
1 Juli 2024

Indhold
Mol er standard måleenhed i kemi, der bruges til at se på de forskellige grundstoffer i en forbindelse. Normalt beregnes sammensat masse i gram (g) og skal konverteres til molære enheder. Overgangen er ganske enkel, men der er stadig nogle vigtige trin, som vi skal følge. Ved hjælp af nedenstående metode kan du nemt konvertere gram til mol.
Trin
Del 1 af 2: Beregn molekylvægt
Forbered de nødvendige forsyninger til at løse det matematiske problem. Når du har alle de tilgængelige værktøjer, bliver det lettere at løse problemet. Hvad du har brug for er:
- Blyant og papir. Matematikken bliver lettere, når du skriver alt ned på papir. Du skal præsentere alle trin for at nå den maksimale score.
- Periodisk system af kemiske grundstoffer: bruges til at bestemme grundstoffernes masseatomer.
- Lommeregner: bruges til at beregne komplicerede tal.

Bestem hvilke elementer der er i den forbindelse, du har brug for at konvertere til molære enheder. Det første trin i beregning af molekylær masse er at bestemme de grundstoffer, der udgør forbindelsen. Dette er let, fordi forkortelsen for elementer kun er et til to tegn.- Hvis et stof forkortes med to bogstaver, verserer det første bogstav med store bogstaver, og det andet bogstav er med små bogstaver. Eksempel: Mg er forkortelsen for elementet magnesium.
- NaHCO-forbindelser3 består af fire grundstoffer: natrium (Na), brint (H), kulstof (C) og ilt (O).
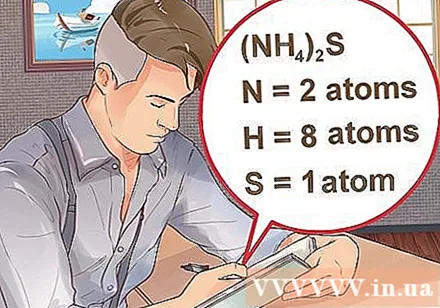
Bestem antallet af atomer for hvert element i forbindelsen. Du skal kende atomnummeret for hvert stof i en forbindelse for at beregne massemolekylet for den forbindelse. Det lille tal ved siden af elementets initialer repræsenterer elementets atomnummer.- Eksempel: forbindelse H2O har to hydrogenatomer og et iltatom.
- Hvis en forbindelse er skrevet i parentes, ledsaget af et lille indeks, betyder det, at hver ingrediens i parentes multiplicerer indekset. Eksempel: forbindelse (NH4)2S består af to N-atomer, otte H-atomer og et S-atom.

Skriv det kubiske atomark for hvert element ned. Brug af det periodiske system er den nemmeste måde at finde et elements kubiske atom på. Når du har fundet elementet i det periodiske system, vil du se atommassen lige under elementets ikon.- For eksempel er det kubiske oxygenatom 15,99.
Beregn molekylmassen. Massemolekylet i et stof er lig med antallet af atomer i hvert element ganget med massens atom i dette element. Denne mængde er essentiel i gram til molær omdannelse.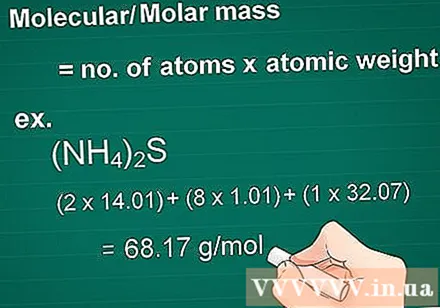
- Multiplicer først atomnummeret for hvert element i forbindelsen med dets massatom.
- Tilføj derefter masserne af elementerne i forbindelsen sammen.
- Eksempel: Molekylmasse af en forbindelse (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- Molekylær masse er også kendt som molær masse.
Del 2 af 2: Konverter gram til mol
Konfigurer konverteringsformlen. For at finde antallet af mol af forbindelsen dividerer du antallet af gram af forbindelsen med den molære masse af den forbindelse.
- Formel: antal mol = masse (gram) / molær masse af forbindelse (gram / mol)
Udskift tallene i formlen. Efter opsætning af den rigtige formel er det næste trin at erstatte de tal, du har beregnet, i formlen. Hvis du vil sikre dig, at dataene er i den korrekte position, kan du kontrollere det ved at undertrykke enheden. Hvis den resterende enhed efter enkelhed er mol, så er du indstillet korrekt.
Løs ligningen. Ved hjælp af en lommeregner divideres massen med det kubiske molekyle af stoffet eller forbindelsen. Kvotienten vil være antallet af mol af det stof eller den forbindelse, du leder efter.
- For eksempel er problemet for 2 g vand (H2O) og bede dig om at konvertere det til molære enheder. Vi har den molære masse af H2O er 18 g / mol. Del 2 med 18, så du har 0,1111 mol H2O.
Råd
- Glem ikke at medtage elementet eller sammensatte navn med svarene.
- Hvis du bliver bedt om at præsentere en øvelse eller quiz, skal du sørge for at vise dit svar tydeligt ved at cirkle eller tegne en boks omkring svarene.
Hvad du har brug for
- Kemisk periodisk system
- Blyant
- Papir
- Computer
- Kemiproblemer



