Forfatter:
Lewis Jackson
Oprettelsesdato:
6 Kan 2021
Opdateringsdato:
1 Juli 2024
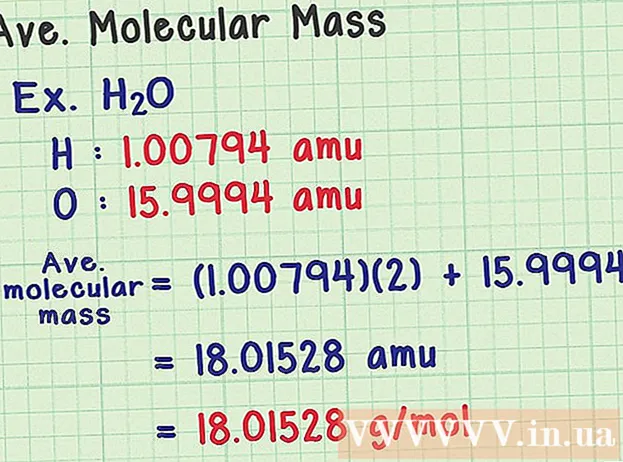
Indhold
Det gennemsnitlige masseatom er ikke et direkte mål for et atoms masse. I stedet er dette den gennemsnitlige masse pr. Atom fra en typisk prøve af elementet. Hvis du kan måle masserne af milliarder af individuelle atomer, kan du finde ud af dette ved at beregne deres gennemsnit. Vi har en mere praktisk metode, der er baseret på information om de forskellige isotoper af det kemiske element.
Trin
Del 1 af 2: Beregn det gennemsnitlige masseatom
Forstå isotoper og masseatomer. I naturen findes de fleste elementer i mange former eller isotoper. Den eneste forskel mellem to isotoper af det samme element er antallet af neutroner i atomet, hvis antal neutroner påvirker masseatomet. Beregning af det gennemsnitlige masseatom tager højde for effekten af denne forskel og fortæller dig den gennemsnitlige masse af hvert atom i en prøve af disse atomer.
- For eksempel har sølv (Ag) to naturlige isotoper: Ag-107 og Ag-109 (eller Ag og Ag). Isotopen er opkaldt efter "massetallet" eller summen af antallet af protoner og antallet af neutroner i et atom. Det betyder, at Ag-109 har to flere neutroner end Ag-107, så dets atom er lidt tungere.

Find massen af hver isotop. Du har brug for to stykker information til hver isotop, du kan slå dem op i referencebøger eller slå op online, for eksempel webelements.com. Den første er masseatom eller atommasse for hver isotop. Isotoper med flere neutroner har mere masse.- For eksempel har sølvisotopen Ag-107 masseatomet 106.90509 amu (enheden af et kubisk atom). Isotopen Ag-109 er lidt tungere med en masse på 108,90470.
- Par decimaler i slutningen kan være lidt forskellige i dokumenterne. Skriv ikke nogen tal i parentes efter massen.

Skriv den naturlige overlevelsesrate for hver isotop. Denne procentdel angiver isotopens popularitet som en procentdel af elementets samlede atomer. Du kan finde disse oplysninger i det samme dokument med et kubisk atom på. Den naturlige overlevelse af alle isotoper skal være 100% (selvom det kan afvige lidt på grund af afrundingsfejlen).- Ag-107 isotop har forholdet 51,86%. Isotopen Ag-109 er mindre almindelig med en hastighed på 48,14%. Det betyder, at en normal sølvprøve har 51,86% Ag-107 og 48,14% Ag-109.
- Alle isotoper, der ikke har denne overlevelsesrate, ignoreres. Disse isotoper findes ikke naturligt på jorden.

Konverter isotopprocenten til et decimaltal. Del dette forhold med 100, hvilket giver den samme værdi som et decimal.- I sølvprøven ovenfor er forholdet mellem isotoper 51,86 / 100 = 0,5186 og 48,14 / 100 = 0,4814.
Find det gennemsnitlige kubiske atom. Et grundstofs gennemsnitlige atom har n isotoper ens (AtomblokIsotop 1 * forholdIsotop 1) + (atommasseIsotop 2 * forholdIsotop 2) + ... + (atommasseisotoper n * forholdisotoper n. Dette er et eksempel på "gennemsnitlig masse", hvilket betyder, at jo større isotopens overlevelsesrate er, desto større er dens virkning på resultatet. Sådan anvendes denne formel til sølv er som følger:
- Medium masse atomAg = (kubisk atomAg-107 * forholdAg-107) + (atommasseAg-109 * forholdAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Find det element i det periodiske system for at kontrollere resultaterne. Det gennemsnitlige kubiske atom er altid skrevet under elementets kemiske symbol.
- Medium masse atomAg = (kubisk atomAg-107 * forholdAg-107) + (atommasseAg-109 * forholdAg-109)
Del 2 af 2: Brug af resultater
Konverter masse til atomnummer. Gennemsnitligt kubisk atom viser forholdet mellem masse og atomnummer i en typisk prøve af dette element. Dette er meget nyttigt i kemiske laboratorier, fordi det er næsten umuligt at nøjagtigt tælle atomer, men masser er lette at bestemme. For eksempel kan du veje en prøve af sølv og vide, at der vil være et sølvatom for hver 107.8677 amu.
Konverter til molær masse. Atommasseenheden er meget lille, så kemikere bruger ofte gramenheden til masse. Heldigvis har vi definitioner af disse begreber, så transformationen skal være let. Multiplicer bare det gennemsnitlige masseatom med 1 g / mol (molær massekonstant) for at få et resultat i g / mol. For eksempel indeholder 107.8677 gram sølv en mol sølvatomer.
Find den gennemsnitlige molekylvægt. Da et molekyle er en samling af atomer, kan du tilføje massen af alle atomer for at finde den molekylære masse. Hvis du bruger et gennemsnitligt masseatom (i stedet for massen af en bestemt isotop), bliver resultatet den gennemsnitlige molekylvægt af en prøve i naturen. Her er et eksempel:
- Et vandmolekyle har den kemiske formel H2O indeholder to hydrogenatomer (H) og et oxygenatom (O).
- Brint har et gennemsnitligt masseatom på 1.00794 amu. Oxygen har en gennemsnitlig atommasse på 15.9994 amu.
- Så den gennemsnitlige molekylvægt af H2O er lig med (1,00794) (2) + 15,9994 = 18,01528 amu, hvilket svarer til 18,01528 g / mol.
Råd
- Begrebet relativ atommasse bruges undertiden synonymt med et gennemsnitligt masseatom. Der er en lille forskel, fordi atommassen er relativt en enhed; det er en måling af massen i forhold til et carbon-12-atom. Så længe du bruger atommasseenheden i den gennemsnitlige kubiske atomberegning, er disse to værdier de samme.
- Antallet i parentes efter det kubiske atom fortæller os fejlen. For eksempel betyder masseatom 1.0173 (4), at elementets normale atom har et masseområde på ca. 1.0173 ± 0.0004. Du behøver ikke at få dette nummer, hvis det ikke anmodes om.
- På det periodiske system er det gennemsnitlige kubiske atom for det følgende element større end det, der er før det, med få undtagelser. Her er en hurtig måde at kontrollere dine resultater på.
- 1 atommasseenhed er 1/12 massen af et carbon-12-atom.
- Isotopoverlevelsesrater beregnes efter typiske naturligt forekommende prøver på jorden. Ikke-naturligt forekommende stoffer såsom meteoritter eller en produceret i et laboratorium kan have forskellige isotopforhold, så det gennemsnitlige masseatom er også forskelligt.
Advarsel
- Masseatomer skrives altid i atommasseenheder (amu eller u), undertiden kaldet dalton (Da). Skriv aldrig en anden masseenhed (f.eks. Et kilogram) efter dette tal uden at ændre det.
Hvad du har brug for
- Blyant
- Papir
- Bærbar
- Data om isotopoverlevelsesrate i naturen.
- Massedataenhedsdata for isotoper.