Forfatter:
Helen Garcia
Oprettelsesdato:
21 April 2021
Opdateringsdato:
1 Juli 2024
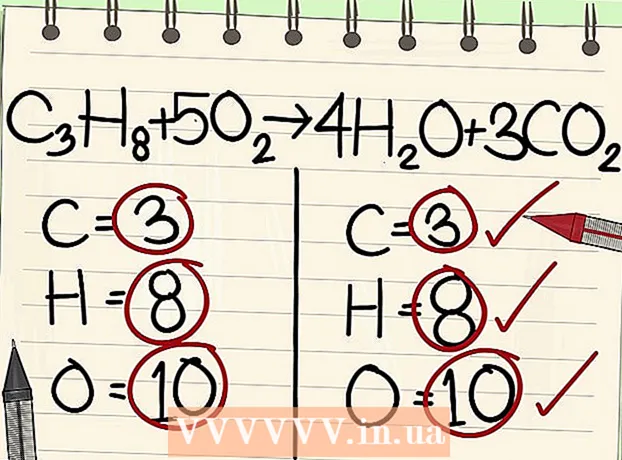
Indhold
En kemisk ligning er en symbolsk repræsentation af en kemisk reaktion. I dette tilfælde er de reagerende forbindelser (reagenser) skrevet til venstre og de resulterende stoffer (reaktionsprodukter) - på højre side af ligningen. En pil er placeret mellem dem fra venstre mod højre, hvilket angiver reaktionsretningen. Ifølge loven om bevarelse af masse kan der i løbet af en kemisk reaktion ikke forekomme nye atomer, eller gamle forsvinder; derfor skal antallet af atomer i reaktanterne være lig med antallet af atomer i produkterne fra den kemiske reaktion . Denne artikel beskriver, hvordan man balancerer kemiske ligninger ved hjælp af forskellige metoder.
Trin
Metode 1 af 2: Traditionel metode
 1 Skriv en kemisk ligning ned. Som et eksempel kan du overveje følgende reaktion:
1 Skriv en kemisk ligning ned. Som et eksempel kan du overveje følgende reaktion: - C3H8 + O2 -> H.2O + CO2
- Denne reaktion beskriver forbrænding af propan (C3H8) i nærvær af ilt til dannelse af vand og kuldioxid (kuldioxid).
 2 Skriv antallet af atomer for hvert element ned. Gør dette for begge sider af ligningen. Bemærk abonnementerne ved siden af hvert element for at bestemme det samlede antal atomer. Skriv symbolet for hvert element i ligningen ned, og noter det tilsvarende antal atomer.
2 Skriv antallet af atomer for hvert element ned. Gør dette for begge sider af ligningen. Bemærk abonnementerne ved siden af hvert element for at bestemme det samlede antal atomer. Skriv symbolet for hvert element i ligningen ned, og noter det tilsvarende antal atomer. - For eksempel får vi på højre side af ligningen, som vi overvejer, som følge af tilsætning 3 iltatomer.
- På venstre side har vi 3 carbonatomer (C3), 8 hydrogenatomer (H8) og 2 iltatomer (O2).
- På højre side har vi 1 carbonatom (C), 2 hydrogenatomer (H2) og 3 iltatomer (O + O2).
 3 Gem brint og ilt til senere, da de er en del af flere forbindelser på venstre og højre side. Brint og ilt er en del af flere molekyler, så det er bedst at balancere dem sidst.
3 Gem brint og ilt til senere, da de er en del af flere forbindelser på venstre og højre side. Brint og ilt er en del af flere molekyler, så det er bedst at balancere dem sidst. - Inden balance mellem brint og ilt skal du genberette atomerne igen, da yderligere faktorer kan være nødvendige for at afbalancere andre grundstoffer.
 4 Start med den mindst hyppige vare. Hvis du har brug for at afbalancere flere elementer, skal du vælge et, der er en del af et reagensmolekyle og et molekyle af reaktionsprodukter. Så kulstoffet skal først afbalanceres.
4 Start med den mindst hyppige vare. Hvis du har brug for at afbalancere flere elementer, skal du vælge et, der er en del af et reagensmolekyle og et molekyle af reaktionsprodukter. Så kulstoffet skal først afbalanceres.  5 For balance skal du tilføje en faktor foran et enkelt carbonatom. Sæt en faktor foran det enkelte carbon på højre side af ligningen for at afbalancere det med 3 carbonatomer i venstre side.
5 For balance skal du tilføje en faktor foran et enkelt carbonatom. Sæt en faktor foran det enkelte carbon på højre side af ligningen for at afbalancere det med 3 carbonatomer i venstre side. - C3H8 + O2 -> H.2O + 3CO2
- En faktor 3 foran carbonet på højre side af ligningen indikerer, at der er tre carbonatomer, som svarer til de tre carbonatomer i propanmolekylet på venstre side.
- I en kemisk ligning kan du ændre koefficienterne foran atomer og molekyler, men abonnementerne skal forblive uændrede.
 6 Afbalancér derefter hydrogenatomerne. Efter at du havde udlignet antallet af carbonatomer på venstre og højre side, var hydrogen og ilt ubalanceret. Den venstre side af ligningen indeholder 8 hydrogenatomer, det samme tal skal være til højre. Opnå dette med et forhold.
6 Afbalancér derefter hydrogenatomerne. Efter at du havde udlignet antallet af carbonatomer på venstre og højre side, var hydrogen og ilt ubalanceret. Den venstre side af ligningen indeholder 8 hydrogenatomer, det samme tal skal være til højre. Opnå dette med et forhold. - C3H8 + O2 -> 4H2O + 3CO2
- Vi har tilføjet en faktor 4 til højre, da abonnementet viser, at vi allerede har to brintatomer.
- Hvis du gange faktor 4 med subscript 2, får du 8.
- Som et resultat opnås 10 oxygenatomer på højre side: 3x2 = 6 atomer i tre 3CO -molekyler2 og yderligere fire atomer i fire vandmolekyler.
 7 Balancere iltatomerne. Husk at indregne de koefficienter, du brugte til at afbalancere de andre atomer. Fordi du tilføjede koefficienterne foran molekylerne på højre side af ligningen, ændrede antallet af iltatomer. Du har nu 4 iltatomer i vandmolekyler og 6 iltatomer i kuldioxidmolekyler. Således er der 10 iltatomer i højre side.
7 Balancere iltatomerne. Husk at indregne de koefficienter, du brugte til at afbalancere de andre atomer. Fordi du tilføjede koefficienterne foran molekylerne på højre side af ligningen, ændrede antallet af iltatomer. Du har nu 4 iltatomer i vandmolekyler og 6 iltatomer i kuldioxidmolekyler. Således er der 10 iltatomer i højre side. - Tilføj en faktor 5 til iltmolekylet på venstre side af ligningen. Hvert stykke indeholder nu 10 iltatomer.
- C3H8 + 5O2 -> 4H2O + 3CO2.

- Så begge sider af ligningen indeholder det samme antal kulstof-, brint- og iltatomer. Ligningen er afbalanceret.
Metode 2 af 2: Algebraisk metode
- 1 Skriv reaktionsligningen ned. Som et eksempel kan du overveje følgende kemiske reaktion:
- PCl5 + H2O -> H3PO4 + HCI
- 2 Sæt et bogstav foran hver forbindelse:
- -enPCl5 + bH2O -> cH3PO4 + dHCl
- 3 Udlign antallet af atomer for hvert element på venstre og højre side af ligningen.
- -enPCl5 + bH2O -> cH3PO4 + dHCl
- Til venstre har vi 2b hydrogenatomer (2 i hver H2O), mens til højre er 3c+d hydrogenatomer (3 i hver H3PO4 og 1 i hvert HCI -molekyle). Da venstre og højre side skal indeholde det samme antal hydrogenatomer, 2b skal være lig med 3c+d.
- Gør dette for alle elementer:
- P: -en=c
- Cl: 5-en=d
- H: 2b=3c+d
- 4 Løs systemet med ligninger for at finde koefficienternes numeriske værdier. Systemet har flere løsninger, da der er flere variabler end ligninger. Det er nødvendigt at finde en sådan løsning, så alle koefficienter har form af de mindste mulige heltal.
- For hurtigt at løse et ligningssystem skal du tildele en af variablerne en numerisk værdi. Antag at a = 1. Lad os løse systemet og finde værdierne for de resterende variabler:
- For P a = c, så c = 1
- For Cl 5a = d, derfor d = 5
- Da for H 2b = 3c + d finder vi værdien b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4
- Således har vi følgende koefficienter:
- a = 1
- b = 4
- c = 1
- d = 5
Tips
- Hvis du har problemer, kan en online lommeregner bruges til at afbalancere kemiske ligninger. Bemærk dog, at en sådan lommeregner ikke må bruges under eksamen, så du skal ikke udelukkende stole på den.
- Husk, at nogle gange kan ligningen forenkles! Hvis alle koefficienter endda er delelige med et helt tal, skal du forenkle ligningen.
Advarsler
- For at slippe af med fraktionskoefficienter ganges hele ligningen (dens venstre og højre side) med nævneren af fraktionen.
- Brug aldrig fraktioner som koefficienter for den kemiske ligning - der er ingen halve molekyler eller atomer i kemiske reaktioner.
- I balanceringsprocessen kan du bruge brøker for nemheds skyld, men ligningen er ikke afbalanceret, så længe der er fraktionskoefficienter i den.